PKompetensi :
- Mahasiswa dapat melakukan pengukuran sel mikroorganisme
- Mahasiswa dapat melakukan perhitungan mikroba dengan cara Plate Count, MPN dan dengan haemocytometer
Menentukan jumlah dan ukuran mikroba
a. Menentukan ukuran mikroba
Menggunakan mikrometer
b. Menentukan jumlah mikroba (enumerasi)
b.1 penghitungan jumlah bakteri hidup (penghitungan tidak langsung)
b.1.1 Plate count (hitungan cawan)
b.1.1.1 SPC
b.1.1.2 TPC
b.1.1.3 cara kerja SPC dan TPC
b.1.2 MPN
b.2 penghitungan jumlah bakteri secara keseluruhan (penghitungan langsung
dengan haemocytometer
· Menentukan Ukuran Mikroorganisme
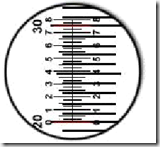
Mikroba berukuran sangat kecil dan untuk mengetahuinya digunakan mikrometer. Mikrometer merupakan kaca berskala dan dikenal 2 jenis micrometer yaitu mikrometer okuler dan mikrometer objektif. Mikrometer okuler dipasang pada lensa okuler mikroskop, sedangkan micrometer objektif berbentuk slide yang ditempatkan pada meja preparat mikroskop. Jarak antar garis skala pada mikrometer okuler tergantung pada perbesaran lensa objektif yang digunakan yang menentukan lapang pandang mikroskop. Jarak ini dapat ditentukan dengan mengkalibrasi antara mikrometer okuler dan objektif. Mikrometer objektif memiliki skala yang telah diketahui, menjadi tolak ukur untuk menentukan ukuran skala micrometer okuler. 1 skala micrometer objektif = 0,01 mm / 10 µm.
Kalibrasi dilakukan dengan menghimpitkan skala mikrometer objektif dan okuler pada perbesaran yang diinginkan. Skala ke nol (garis pertama) kedua mikrometer disimpulkan menjadi 1 garis kemudian dilihat pada skala ke berapa kedua jenis mikrometer tersebut bertemu/berhimpit kembali. Dari hasil tersebut dapat diketahui satu satuan panjang pada skala mikrometer okuler itu berdasarkan beberapa jumlah skala kecil mikrometer objektif yang berada di antara garis yang berhimpit tadi.

Misal : jika skala ke 0 mikrometer okuler berhimpit dengan skala ke 0 mikrometer objektif lalu skala ke 13 mikrometer okuler berhimpit dengan skala ke 2 mikrometer objektif maka beberapa 1 skala okuler.
Cara Kerja :
Kalibrasi :
· Letakkan mikrometer objektif pada meja benda dan pasang mikrometer okuler pada tabung lensa okuler.
·Tentukan perbesaran yang digunakan, (misalnya 40 X 10) kemudian cari gambar perbesaran dari skala mikrometer objektif.
·Setelah fokus didapat, kemudian selanjutnya himpitkan skala ke nol mikrometer objektif dan okuler.
·Cari dengan teliti skala ke berapa antara mikrometer objektif dan okuler yang berhimpit lagi.
·Hitung besarnya skala okuler dengan rumus di atas.
Kalibrasi :
· Letakkan mikrometer objektif pada meja benda dan pasang mikrometer okuler pada tabung lensa okuler.
·Tentukan perbesaran yang digunakan, (misalnya 40 X 10) kemudian cari gambar perbesaran dari skala mikrometer objektif.
·Setelah fokus didapat, kemudian selanjutnya himpitkan skala ke nol mikrometer objektif dan okuler.
·Cari dengan teliti skala ke berapa antara mikrometer objektif dan okuler yang berhimpit lagi.
·Hitung besarnya skala okuler dengan rumus di atas.
Penentuan ukuran mikroba
-Lepaskan mikrometer objektif dari meja benda.
-Ganti dengan preparat ulas yang telah disiapkan
-Cari fokus dari preparat tersebut dengan perbesaran yang sama.
-Hitung berapa panjang sel dengan menghitung skala mikrometer okuler.
-Jika diperlukan hitung lebar sel dengan cara yang sama. Tabung lensa okuler dapat diputar dan dicari posisi yang pas.
-Hitung panjang dan lebar sel sebenarnya :
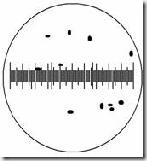
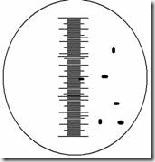
Hitung panjang dan lebar sel sebenarnya :
x skala okuler X hasil kalibrasi
y skala okuler X hasil kalibrasi
misal : 5 X 1,54 = 7,7 µm
2 X 1,54 = 3,08 µm
· Menentukan jumlah mikroorganisme (enumerasi)
A. penghitungan jumlah bakteri hidup (tidak langsung)
a.1. Plate Count (hitungan cawan)
Plate count / viable count didasarkan pada asumsi bahwa setiap sel mikroorganisme hidup dalam suspensi akan tumbuh menjadi satu koloni setelah ditumbuhkan dalam media pertumbuhan dan lingkungan yang sesuai. Setelah diinkubasi, jumlah koloni yang tumbuh dihitung dan merupakan perkiraan atau dugaan dari jumlah mikroorganisme dalam suspensi tersebut.
Koloni yang tumbuh tidak selalu berasal dari satu sel mikroorganisme karena beberapa mikroorganisme tertentu cenderung membentuk kelompok atau berantai. Berdasarkan hal tersebut digunakan istilah Coloni Forming Units (CFU’s) per ml. koloni yang tumbuh berasal dari suspensi yang diperoleh menggunakan pengenceran bertingkat dari sebuah sampel yang ingin diketahui jumlah bakterinya.
Syarat koloni yang ditentukan untuk dihitung adalah sebagai berikut “
- Satu koloni dihitung 1 koloni.
- Dua koloni yang bertumpuk dihitung 1 koloni.
- Beberapa koloni yang berhubungan dihitung 1 koloni.
- Dua koloni yang berhimpitan dan masih dapat dibedakan dihitung 2 koloni.
- Koloni yang terlalu besar (lebih besar dari setengah luas cawan) tidah dihitung.
- Koloni yang besarnya kurang dari setengah luas cawan dihitung 1 koloni.

- Satu koloni dihitung 1 koloni.

- Dua koloni yang bertumpuk dihitung 1 koloni.
- Beberapa koloni yang berhubungan dihitung 1 koloni.
- Dua koloni yang berhimpitan dan masih dapat dibedakan dihitung 2 koloni.
- Koloni yang terlalu besar (lebih besar dari setengah luas cawan) tidah dihitung.
- Koloni yang besarnya kurang dari setengah luas cawan dihitung 1 koloni.

Cara menghitung sel relatif / CFU’s per ml
CFU’s / ml = jumlah koloni X faktor pengenceran
Misal : penanaman dilakukan dari tabung pengenceran 10 -6 dengan metode Spread Plate dan Pour Plate.
Spread plate : koloni = 50 = 50 x 106 CFU’s / 0,1 ml
Fp = 1/10 -6 = 50 000 000 CFU’s / 0,1 ml
SP = 0,1 ml = 500 000 000 CFU’s / ml
= 5x108 CFU’s / ml
Pour plate : koloni = 50 = 50 x 106 CFU’s / 1 ml
Fp = 1/10 -6 = 50 000 000 CFU’s / 0,1 ml
SP = 1 ml = 5x107 CFU’s / ml
CFU’s / ml = jumlah koloni X faktor pengenceran
Misal : penanaman dilakukan dari tabung pengenceran 10 -6 dengan metode Spread Plate dan Pour Plate.
Spread plate : koloni = 50 = 50 x 106 CFU’s / 0,1 ml
Fp = 1/10 -6 = 50 000 000 CFU’s / 0,1 ml
SP = 0,1 ml = 500 000 000 CFU’s / ml
= 5x108 CFU’s / ml
Pour plate : koloni = 50 = 50 x 106 CFU’s / 1 ml
Fp = 1/10 -6 = 50 000 000 CFU’s / 0,1 ml
SP = 1 ml = 5x107 CFU’s / ml
Koloni yang dipilih untuk dihitung menggunakan cara SPC memiliki syarat khusus berdasarkan statistic untuk memperkecil kesalahan dalam perhitungan. Perhitungan mengacu kepada standar atau peraturan yang telah ditentukan. Syarat-syaratnya sebagai berikut :
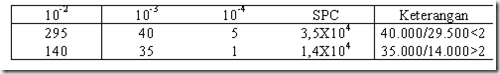
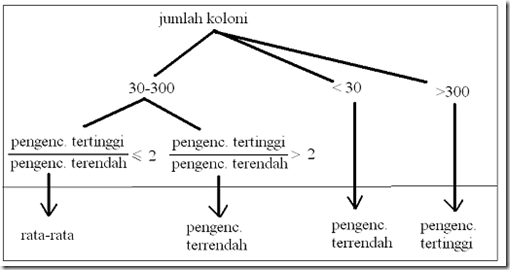
- Pilih cawan yang ditumbuhi koloni dengan jumlah 30-300 koloni. > 300 = TNTC (Too Numerous To Count) atau TBUD (Terlalu Banyak Untuk Dihitung). < 30 = TFTC (Too Few To Count).
- Jumlah koloni yang dilaporkan terdiri dari 2 digit yaitu angka satuan dan angka sepersepuluh yang dikalikan dengan kelipatan 10 (eksponensial), missal 2,3 X 104, bukan 2,34 X 104. pembulatan keatas dilakukan pada angka seperseratus yang sama atau lebih besar dari lima, missal 2,35 X 104 menjadi 2,4 X 104, atau 2,34 X 104 menjadi 2,3 X 104
- Bila diperoleh perhitungan kurang dari 30 dari semua pengenceran, maka hanya dari pengenceran terendah yang dilaporkan.
- Bila diperoleh perhitungan >300 dari semua pengenceran, maka hanya dari pengenceran tertinggi yang dilaporkan. Misalnya dengan cara menghitung jumlahnya pada ¼ bagian (transek) cawan kemudian hasilnya dikalikan empat. Hasil tersebut dilaporkan sebagai lebih dari 300 dikalikan dengan besarnya faktor pengenceran, tetapi jumlah sebenarnya harus dicantumkan dalam tanda kurung.
- Bila ada 2 cawan, masing-masing dari pengenceran rendah dan tinggi yang berurutan dengan jumlah koloni 30-300 dan hasil bagi dari jumlah koloni pengenceran tertinggi dan terendah ≤ 2, maka jumlah yang dilaporkan adalah nilai rata-rata. Jika hasil bagi dari pengenceran tertinggi dan terendah > 2 maka jumlah yang dilaporkan adalah dari cawan dengan pengenceran terendah.
- Apabila setiap pengenceran digunakan dua cawan Petri (duplo), maka jumlah angka yang digunakan adalah data dari kedua cawan, tidak boleh diambil salah satu, meskipun salah satu dari cawan duplo tersebut tidak memenuhi syarat diantara 30-300. Data yang dilaporkan adalah rata-rata dari kedua cawan duplo tersebut.
bagan untuk mempersingkat syarat SPC
![clip_image002[8]](http://lh5.ggpht.com/yanpusmeong/SNNhR9FmSzI/AAAAAAAAAKE/nVBvUUgiIiA/clip_image0028_thumb1.jpg) Penghitungan koloni pada cawan sebaiknya dibuat transek atau dibagi-bagi jika koloni yang tumbuh terlalu banyak. Transek dibuat dengan spidol/marker di bagian bawah cawan petri. Pola transek dapat dibuat bervariasi, tergantung kebutuhan. Penghitungan akan lebih mudah bila memakai Colony Counter.
Penghitungan koloni pada cawan sebaiknya dibuat transek atau dibagi-bagi jika koloni yang tumbuh terlalu banyak. Transek dibuat dengan spidol/marker di bagian bawah cawan petri. Pola transek dapat dibuat bervariasi, tergantung kebutuhan. Penghitungan akan lebih mudah bila memakai Colony Counter.a.1.3 Prosedur perhitungan jumlah bakteri dengan metode Plate Count.
-Lakukan preparasi suspensi kepada sampel terlebih dahulu (swab, maserasi dan rinse) (jika perlu).
-Masukkan sampel ke tabung berisi 9 ml akuades untuk pengenceran pertama, selanjutnya diencerkan sampai tingkat pengenceran (misalnya sampai 10-8) tertentu.
-Dari 3 pengenceran terakhir diplating (ditanam) ke media NA (Nutrien Agar) atau PCA (Plate Count Agar) sebanyak dua kali tiap pengenceran (duplo). Plating dapat secara Spread Plate atau Pour Plate. Jika secara Spread Plate, dapat digunakan batang L atau glass beads.
-Inkubasi pada suhu 30º C selama 1-2 x 24 jam.
-Setelah tumbuh, koloni dihitung dengan persyaratan yang telah diuraikan di depan.
lihat juga Prinsip Dasar Teori Menghitung Mikroorganisme Pada Cawan (bagian 2)
a.2 Most Probable Number (MPN)
Pendekatan lain untuk enumerasi bakteri hidup adalah dengan metode MPN. MPN didasarkan pada metode statistik (teori kemungkinan). Metode MPN ini umumnya digunakan untuk menghitung jumlah bakteri pada air khususnya untuk mendeteksi adanya bakteri koliform yang merupakan kontaminan utama sumber air minum. Ciri-ciri utamanya yaitu bakteri gram negatif, batang pendek, tidak membentuk spora, memfermentasi laktosa menjadi asam dan gas yang dideteksi dalam waktu 24 jam inkubasi pada 37º C. Sampel ditumbuhkan pada seri tabung sebanyak 3 atau 5 buah tabung untuk setiap kelompok. Apabila dipakai 3 tabung maka disebut seri 3, dan jika dipakai 5 tabung maka disebut 5 seri. Media pada tabung adalah Lactose Broth yang diberi indikator perubahan pH dan ditambah tabung durham. Pemberian sampel pada tiap seri tabung berbeda-beda. Untuk sampel sebanyak 10 ml ditumbuhkan pada media LBDS (Lactose Broth Double Stregth) yang memiliki komposisi Beef extract (3 gr), peptone (5 gr), lactose (10 gr) dan Bromthymol Blue (0,2 %) per liternya. Untuk sampel 1 ml dan 0,1 ml dimasukkan pada media LBSS (Lactose Broth Single Stregth) yang berkomposisi sama tapi hanya kadar laktosa setengah dari LBDS yaitu 5 gr.
Berdasar sifat coliform, maka bakteri ini dapat memfermentasikan laktosa menjadi asam dan gas yang dideteksi oleh berubahnya warna dan gas dalam tabung durham. Nilai MPN ditentukan dengan kombinasi jumlah tabung positif (asam dan gas) tiap serinya setelah diinkubasi.
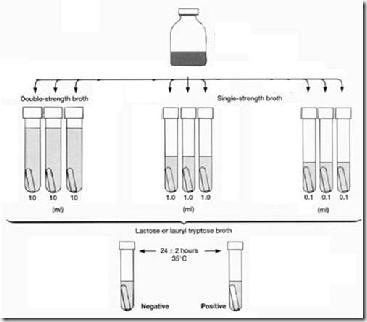
Cara kerja :
1. Sediakan 3 tabung berisi LBDS (9 ml tiap tabung) dan 6 tabung berisi LBSS (9 ml tiap tabung) lengkap dengan tabung durham. Atur kesembilan tabung menjadi 3 seri (seperti di gambar).
2. Kocok botol yang berisi air sampel.
3. Pindahkan suspensi air sample sebanyak 10 ml ke masing-masing tabung seri pertama (3 tabung LBDS), secara aseptis.
4. Pindahkan suspensi air sampel sebanyak 1 ml ke masing-masing tabung seri kedua (3 tabung LBSS), secara aseptis.
5. Pindahkan suspensi air sampel sebanyak 1 ml ke masing-masing tabung seri ketiga (3 tabung LBSS), secara aseptis.
6. Inkubasi semua tabung pada suhu 37º C selama 48 jam.
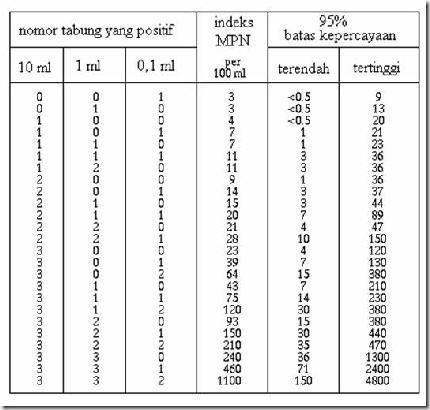
7. Lihat tabung gas positif (asam dan gas ; harus ada keduanya), lalu hitung tabung positif untuk tiap seri. Tulis kombinasi tabung positif tiap seri (misal : 3 2 1). Kombinasi angka tersebut lalu dicocokkan dengan tabel MPN untuk seri 3 sehingga diperoleh jumlah mikroba sebenarnya.
Misal :
![clip_image006[4]](http://lh4.ggpht.com/_kFz4vOoppxQ/SSKlbHmxyQI/AAAAAAAAAXA/xNyvhfxrPKc/clip_image0064_thumb1.jpg) didapatkan kombinasi jumlah tabung positif : 321 maka jumlah bakteri coliform adalah 150 sel/100 ml.
didapatkan kombinasi jumlah tabung positif : 321 maka jumlah bakteri coliform adalah 150 sel/100 ml.A. Penghitungan jumlah bakteri secara keseluruhan (langsung)
Penghitungan secara langsung dapat dilakukan secara mikroskopis yaitu dengan menghitung jumlah bakteri dalam satuan isi yang sangat kecil. Alat yang digunakan adalah Petroff-Hauser Chamber atau Haemocytometer. Jumlah cairan yang terdapat antara coverglass dan alat ini mempunyai volume tertentu sehingga satuan isi yang terdapat dalam satu bujur sangkar juga tertentu.
Ruang hitung terdiri dari 9 kotak besar dengan luas 1 mm². Satu kotak besar di tengah, dibagi menjadi 25 kotak sedang dengan panjang 0,2 mm. Satu kotak sedang dibagi lagi menjadi 16 kotak kecil. Dengan demikian satu kotak besar tersebut berisi 400 kotak kecil. Tebal dari ruang hitung ini adalah 0,1 mm. Sel nakteri yang tersuspensi akan memenuhi volume ruang hitung tersebut sehingga jumlah bakteri per satuan volume dapat diketahui.
Luas kotak sedang := p x l
= 0,2 x 0,2 = 0,04 mm2 jadi misalnya diperoleh:
Volume kotak sedang : 20 sel dalam satu kotak sedang
= 0,04 mm2 x 0,1 mm maka jumlah sel keseluruhan :
= 0,004 mm3 = 20 x (1/4) x 106
Karena 1 ml = 1cm2 = 5 x 106 sel/ml
Maka :
= 0,004 mm3
= 0,000004 cm3
= 4x10-6 ml
Sel/ml :
= jumlah sel/4x10-6 ml
= (jumlah sel/4) x 106
= jumlah sel x (¼) x 106
= jumlah sel x 2,5 x 105
Kotak sedang :
Jumlah sel/ml = jumlah sel x 2,5 x 105
Dengan perhitungan yang sama maka diperoleh rumus untuk
kotak kecil :
Jumlah sel/ml = jumlah sel x 4 x 106
1. Cara kerja (digunakan kotak sedang) :
2. Bersihkan Petroff-Hauser Counting Chamber atau Haemocytometer dengan alkohol 70 % lalu 3. keringkan dengan tissue.
4. Letakkan cover glass di atas alat hitung.5. Tambahkan ± 50 µl suspensi sel yeast (kira-kira 1 tetes) dengan cara meneteskan pada parit kaca pada alat hitung. Suspensi sel akan menyebar karena daya kapilaritas.
6. Biarkan sejenak sehingga sel diam di tempat (tidak terkena aliran air dari efek kapilaritas).7. Letakkan alat hitung pada meja benda kemudian cari fokusnya pada perbesaran 40x10.
8. Lakukan perhitungan secara kasar apakah diperlukan pengenceran atau tidak. Jika dalam satu kotak sedang terdapat sel-sel yang banyak dan bertumpuk maka perhitungan akan tidak akurat dan diperlukan pengenceran dengan perbandingan 1:5 atau 1:10.
9. Hitung sampel, paling tidak sebanyak 5 kotak sedang (lebih banyak lebih baik). Hasil perhitungan dirata-rata kemudian hasil rataan dimasukkan rumus untuk kotak sedang. Jika dilakukan pengenceran maka jumlah sel/ml dikalikan faktor pengenceran.
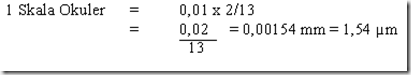



![clip_image008[4]](http://lh5.ggpht.com/_kFz4vOoppxQ/SSKle_mL12I/AAAAAAAAAXI/4yfGSMrrzxs/clip_image0084_thumb.jpg)
![clip_image010[4]](http://lh4.ggpht.com/_kFz4vOoppxQ/SSKlh_V2NJI/AAAAAAAAAXQ/rcQaa_NSsOA/clip_image0104_thumb.jpg)
![clip_image012[5]](http://lh6.ggpht.com/_kFz4vOoppxQ/SSKlmPZzAaI/AAAAAAAAAXY/Ibbhjgpxq_4/clip_image0125_thumb2.jpg)




1 komentar:
Nice info. Mksih Biologipedia:)
Posting Komentar